PADCEV foi avaliado vs quimioterapia no estudo de fase 3, EV-301 com sobrevida global (SG) como endpoint primário3
O EV-301 avaliou PADCEV versus quimioterapia de escolha do investigador em um estudo randomizado, multicêntrico, de fase 3 com 608 pacientes3

*O docetaxel foi administrado a 75 mg/m2, o paclitaxel foi administrado a 175 mg/m2 e a vinflunina foi administrada a 320 mg/m2 3
- Nenhum teste de biomarcador foi necessário para entrada no estudo3
Principais critérios de elegibilidade do EV-3011,3
Principais critérios de inclusão
- Tratamento prévio com quimioterapia contendo platina no cenário neoadjuvante, adjuvante ou localmente avançado ou metastático†
- Tratamento prévio com um inibidor de PD-(L)1 no cenário localmente avançado ou metastático ECOG PS de 0 ou 1
Principais critérios de exclusão
- Neuropatia sensorial ou motora em curso Grau ≥2
- Diabetes não controlado‡
- Metástases ativas do sistema nervoso central
- Ceratite ativa ou ulcerações córneas – Pacientes que tivessem recebido mais de uma quimioterapia anterior para o la/mUC, incluindo neoadjuvância e adjuvância
†Se a platina foi administrada no cenário neoadjuvante/adjuvante, o paciente deve ter progredido dentro de 12 meses após a conclusão.3 ‡A diabetes não controlada foi definida como hemoglobina A1c (HbA1c) ≥8% ou HbA1c ≥7% com sintomas de diabetes associados.1 ECOG PS=Eastern Cooperative Oncology Group performance status; IV=intravenoso; TRO = taxa de resposta objetiva; SG = Sobrevida Global;
PD-(L)1=receptor de morte programado-1 ou ligante de morte programado 1; SLP = sobrevida livre de progressão; RECIST=Critérios de Avaliação de Resposta em Tumores Sólidos.
Quimioterapia contendo platina: EV-301 incluiu pacientes que já haviam recebido quimioterapia contendo platina e um inibidor de PD-(L)11,3
Pacientes politratados e de pior prognóstico foram incluídos no EV-3013
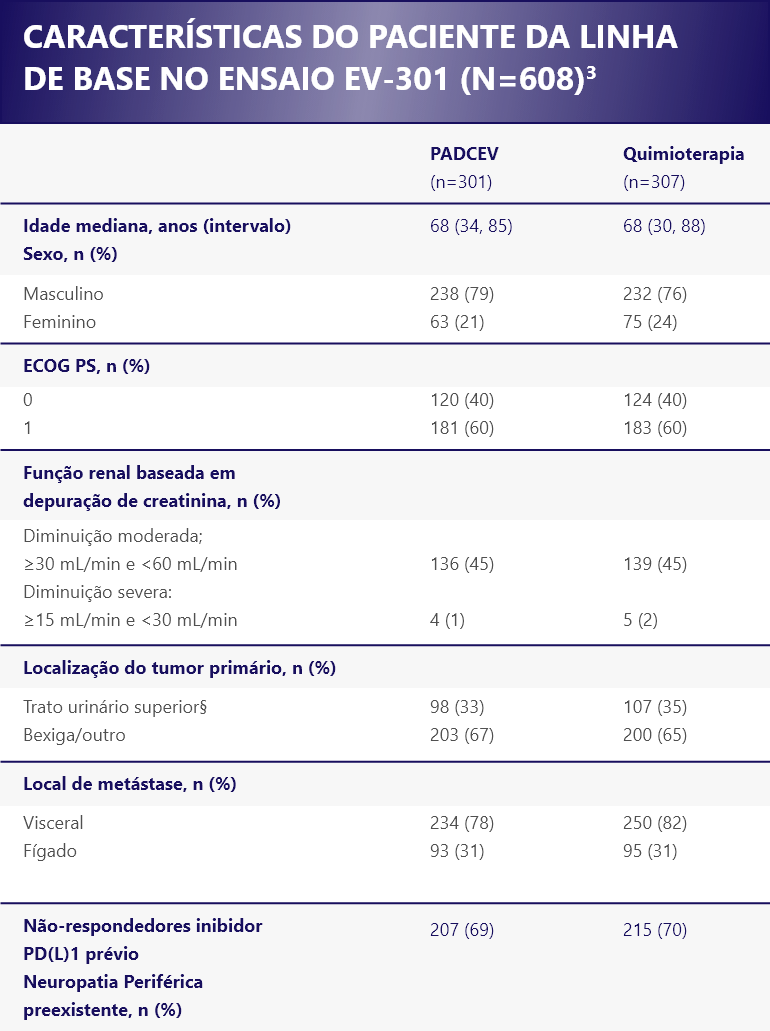

§Trato superior incluído pelve renal e ureter.1

